治験/臨床研究とは
現在私たちが使っている病気・けがの治療または予防のための「薬」や「治療法」は、長い年月と多くの方々の協力によって誕生したものです。しかし、まだ有効な薬や治療法がない病気も多く、新たな治療方法の誕生を待ち望んでいる患者さんがたくさんいらっしゃいます。
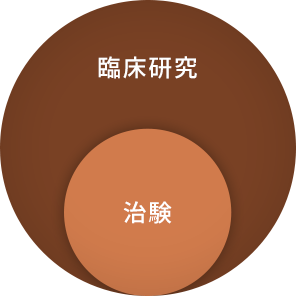
病気の予防・診断・治療方法の改善や病気の原因の解明、患者さんの生活の質の向上を目的に、「人」を対象として行われる研究を「臨床研究」といいます。
「臨床研究」の中で、特に、新しい薬の誕生のために、人での有効性と安全性を確かめて、薬として国(厚生労働省)の承認を得るための試験のことを「治験」といいます。治験の結果は、国(厚生労働省)で厳しく審査され、承認されれば多くの患者さんに使用できるようになります。
「臨床研究」や「治験」は、病気の予防やより良い治療法の確立のため、また有効な新しい薬を安全に医療で使えるようにするために、なくてはならないものです。
治験/臨床研究のルール
治験や臨床研究は、研究に参加する患者さんの人権や安全性、プライバシーを守るため、国(厚生労働省)が定めた厳しいルールを守って行なわれます。
ルールは研究のタイプによっていくつかあり、以下のようなものがあります。
- 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律:薬に関するルール
- GCP(Good Clinical Practice)「医薬品の臨床試験の実施の基準」:治験のルール
- 臨床研究法:特定臨床研究という、国が定める特定の条件に当てはまる研究を実施するためのルール
- 人を対象とする生命科学・医学系研究に関する倫理指針:特定臨床研究以外の臨床研究のためのルール
- 再生医療等の安全性の確保等に関する法律:再生医療等技術を用いて行われる医療のルール
治験/臨床研究への参加は、患者さんの自由意思によって決定できます。
治験/臨床研究を開始する前に、研究を担当する医師や治験協力者(治験コーディネーター)から、研究の目的や方法、使用する薬、治療法の効果や副作用などについて詳しく説明します。これらの内容を十分に納得いただいたうえで、患者さんの意思で研究に参加するかどうかを決めていただきます。
インフォームドコンセントは、参加される患者さんの人権や安全を守るために、特に重要なプロセスです。
研究に参加しないからといって、患者さんの不利益になることは一切ありません。また一度参加を始めた後でも、参加を取りやめたいときは、いつでもやめることができます。その後も通常の治療を受けられます。